醫藥網11月30日訊 11月29日,亞寶藥業發布公告稱,公司收到了國家藥監局核準簽發的苯甲酸阿格列汀片《藥品注冊批件》。報告顯示,苯甲酸阿格列汀片zui早由日本武田藥品工業株式會社研究開發,于2010年在日本上市,2013年在中國獲批進口藥品上市,商品名“尼欣那”。
表1:藥品注冊批件主要內容
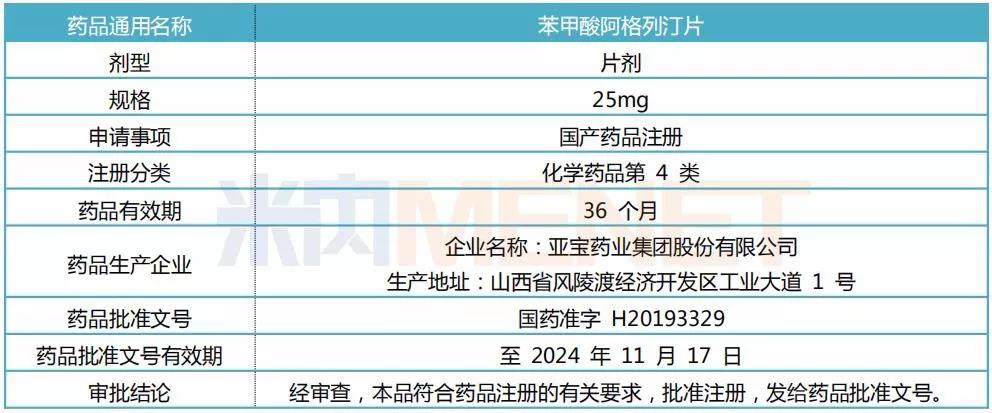
(來源:公司公告)
圖1:中國公立醫療機構需求端化學藥口服糖尿病用藥年度銷售趨勢(單位:萬元)
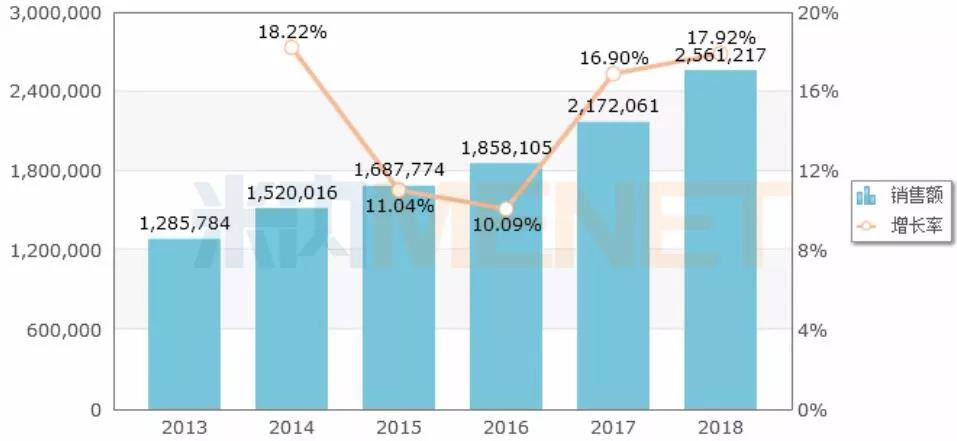
(來源:米內網中國公立醫療機構需求端競爭格局)
圖2:中國公立醫療機構需求端化學藥阿格列汀年度銷售趨勢(單位:萬元)
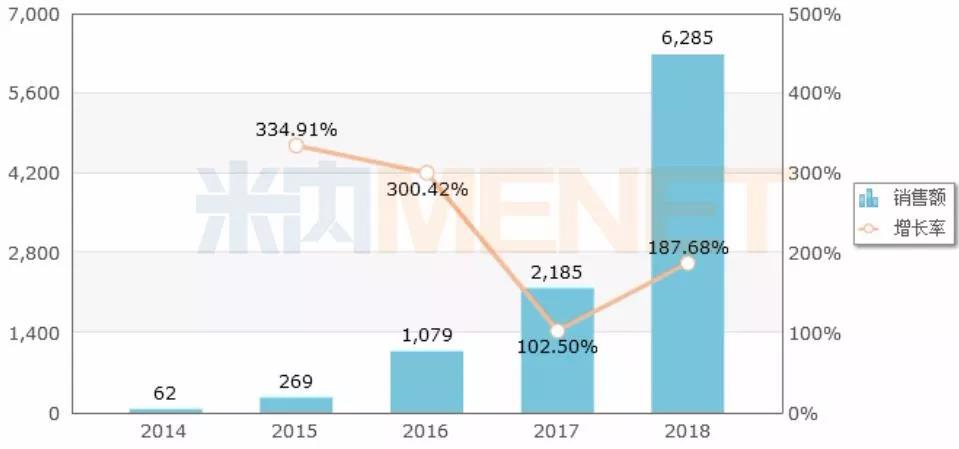
(來源:米內網中國公立醫療機構需求端競爭格局)
米內網報告顯示,2018年在中國城市公立醫院、縣級公立醫院、城市社區中心及鄉鎮衛生院(一般稱作中國公立醫療機構)需求端化學藥口服糖尿病用藥市場規模已經達到了256億元。
據悉,苯甲酸阿格列汀片主要適用于治療2型糖尿病,zui早由日本武田藥品工業株式會社研究開發,于2010年在日本上市,米內網跨國上市公司銷售數據庫報告顯示,2017年該產品的世界銷售額為537億日元(大概在5億美元)。
2013年,原研產品在中國獲批進口上市,商品名“尼欣那”,2018年在中國公立醫療機構需求端銷售額達6285萬元,增長率為187.68%,該產品為2019版國家醫保目錄乙類產品,產品進入國產化后將迎來市場放量。
亞寶藥業在公告中提到,公司首次提交苯甲酸阿格列汀片注冊申請的受理時間為2017年2月22日,當前除該公司外國內尚無其他公司取得苯甲酸阿格列汀片藥品注冊批件。截止當前,公司在該產品研究開發項目上已投入研究開發費用大概在889萬元人民幣。
米內網MED中國藥品審評數據庫2.0報告顯示,截止2019年11月29日,苯甲酸阿格列汀片在審的仿制上市申請企業還有深圳市海濱制藥、石藥歐意藥業、湖南千金湘江藥業、國藥集團國瑞藥業、廣東東陽光藥業、江蘇諾泰澳賽諾生物制藥、江蘇中天藥業、江蘇德源藥業,注冊分類都是4類仿制。
來源:米內網數據庫、上市公司公告
【免責聲明】天賜網對以上發布之所有信息,力爭可靠、準確及全面,但不對其精確性及完整性做出保證,僅供參考。您于此接受并承認信賴任何信息所生之風險應自行承擔,天賜網不承擔任何責任。如本網轉載稿件涉及版權等問題,請作者一周內來電或來函聯系。


